Việc cách tính cung người chết đã trở thành một phần không thể thiếu trong văn hóa và phong tục tập quán của người Việt Nam. Truyền thống này thể hiện lòng thành kính đối với người đã khuất và sự quan tâm đến tôn ti trật tự trong cuộc sống sau cái chết. Trong bài viết này, chúng ta sẽ cùng tìm hiểu sâu về phương pháp tính toán cung người chết, những yếu tố liên quan và ý nghĩa tâm linh của nó trong đời sống người dân Việt.
Giới thiệu chung về cách tính cung người chết
Trước khi đi vào chi tiết, cần hiểu rằng cung người chết không chỉ đơn thuần là một phép toán hay một quy trình mà còn mang trong mình rất nhiều ý nghĩa tâm linh sâu sắc. Việc tính toán này được thực hiện nhằm đảm bảo rằng linh hồn người đã khuất sẽ được an nghỉ, không bị quấy rối, đồng thời cũng giúp gia đình tránh được những điều xui xẻo có thể xảy ra nếu như việc tang lễ không được tiến hành đúng cách.
Cung người chết gắn liền với nghi thức tang lễ và thường mang theo nhiều nghi lễ phức tạp. Điều này cho thấy sự tôn trọng và lòng thành kính mà người sống dành cho tổ tiên, ông bà, cha mẹ. Đó cũng là lý do tại sao việc tìm hiểu và thực hiện cách tính cung người chết lại quan trọng đến vậy trong văn hóa Việt Nam.
Tổng quan về cách tính cung người chết
Tại sao cần tính cung người chết trong văn hóa Việt Nam?
Việc tính cung người chết thực sự rất cần thiết trong các nghi lễ tang lễ, và dưới đây là một số lý do nổi bật:
- Bảo Đảm An Toàn và Hài Lòng: Theo tín ngưỡng dân gian, việc an táng hoặc cúng giỗ không đúng cách có thể dẫn đến những điều tai ương cho gia đình. Tính toán cung người chết giúp tránh những điều không may, từ đó mang lại bình an cho cả gia đình.
- Giúp Linh Hồn An Nghỉ: Khi mọi thứ được thực hiện chính xác theo cung, linh hồn người đã khuất sẽ được an nghỉ hơn và không gặp phải những rắc rối trong thế giới bên kia.
- Tôn Trọng Tổ Tiên: Việc thi hành đúng quy trình tính cung thể hiện lòng tri ân và biết ơn với tổ tiên, điều này góp phần làm cho các thế hệ sau cảm nhận rõ hơn giá trị của truyền thống gia đình.
Nguồn gốc và lịch sử tục tính cung tử
Tục tính cung người chết có nguồn gốc từ triết học phương Đông, được phát triển qua nhiều thế hệ và có sự ảnh hưởng mạnh mẽ từ các trường phái tư tưởng như Đạo giáo, Nho giáo. Người Việt đã ứng dụng những tín ngưỡng này vào thực tiễn tang lễ của mình, tạo nên những quy chuẩn riêng biệt.
Theo thời gian, tục tính cung đã trở thành một phần không thể thiếu trong văn hóa Việt Nam. Mỗi vùng miền đều có cách hiểu và thực hành riêng về cung người chết, nhưng nhìn chung, điểm chung vẫn là sự tôn trọng và lòng thành kính dành cho người đã khuất.
Mỗi gia đình đều có những ký ức đẹp và ý nghĩa riêng với từng người đã mất, và việc tính cung giúp họ giữ gìn và phát huy những giá trị này vào đời sống hàng ngày.
Kiến thức cơ bản về cung tử trong tâm linh Việt
Cung tử không chỉ là một khái niệm thuần túy trong phong thủy mà còn mang ý nghĩa sâu xa trong đời sống tâm linh của người Việt. Cung tử đóng vai trò quan trọng trong việc định hướng sự an lành cho gia đình và con cháu ở thế gian này.
Cung tử là một khái niệm mang ý nghĩa sâu xa trong đời sống tâm linh của người Việt
Các loại cung và đặc điểm chính
Có nhiều loại cung khác nhau trong văn hóa Việt Nam, mỗi loại có đặc điểm và ý nghĩa riêng. Dưới đây là một số loại cung chính:
- Cung bản mệnh: Đây là cung thể hiện sức khỏe và tài vận của người sống. Nó có ảnh hưởng trực tiếp đến cuộc sống và tương lai của họ.
- Cung sanh: Phản ánh về sự sinh sản và sự phát triển trong gia đình. Cung sanh có thể ảnh hưởng đến số lượng và sức khỏe của con cái.
- Cung phi: Gắn liền với vị trí của người đã khuất trong gia đình, giúp định hình mối quan hệ giữa các thế hệ.
- Cung tử: Đây là cung đặc biệt quan trọng, ảnh hưởng đến hậu sự và thịnh vượng của gia đình sau khi người đã khuất ra đi.
Cung tử và ảnh hưởng đến hậu sự
Cung tử chính là yếu tố quyết định đến cách thức chọn lựa ngày giờ, hướng an táng cho người đã khuất. Một cung tử tốt sẽ mang lại sự hanh thông cho gia đình, ngược lại, nếu phạm phải cung xấu, có thể gây ra nhiều bất lợi cho người sống, đặc biệt là cho con cháu.
Việc tính toán cung tử không chỉ để tuân theo phong tục mà còn thể hiện sự kỳ vọng vào tương lai tươi sáng cho thế hệ tiếp theo trong gia đình. Điều này cũng có thể là động lực cho những hành động thiện nguyện và tích cực của người sống, nhằm cầu nguyện cho linh hồn người đã khuất được an yên.
Cách tính cung người chết đúng chuẩn truyền thống
Để có thể tính được cung người chết một cách chính xác, cần phải chuẩn bị đầy đủ các thông tin và tuân theo quy trình cụ thể. Dưới đây là các bước quan trọng trong quá trình này.
Cách tính cung người chết đúng chuẩn truyền thống
Thông tin cần chuẩn bị trước khi tính cung tử
Đầu tiên, bạn cần thu thập các thông tin cần thiết trước khi tiến hành tính cung tử. Những thông tin này bao gồm:
- Ngày, tháng, năm mất theo âm lịch: Đây là yếu tố rất quan trọng, vì lịch âm có sự khác biệt so với lịch dương, và ảnh hưởng lớn đến kết quả tính toán.
- Tuổi âm lịch và giới tính của người đã khuất: Hai thông tin này giúp xác định độ tuổi và giới tính trong quá trình tính toán.
- Thời gian mất (giờ mất): Giờ mất cũng ảnh hưởng đến việc chọn giờ an táng, nhập quan.
Việc xác định chính xác các yếu tố này sẽ giúp bạn có được kết quả chính xác trong quá trình tính toán.
Quy trình chi tiết tính cung người chết
Quy trình tính cung tử có thể được chia thành các bước cơ bản sau:
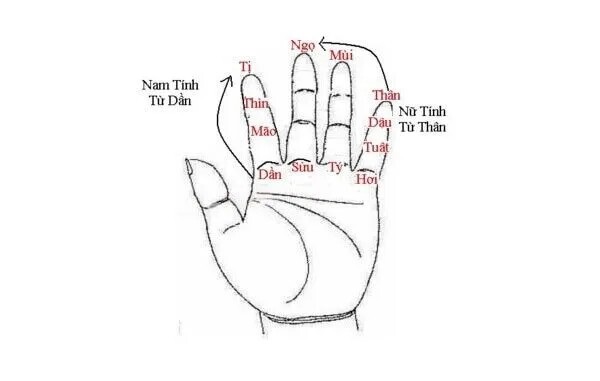
- Bước 1: Xác định tuổi âm của người đã khuất, sau đó chuyển sang các cung theo chu trình (Càn, Đoài, Cấn…).
- Bước 2: Dựa trên giới tính, tiến hành tính các cung tương ứng. Nam và nữ sẽ có các cung khác nhau.
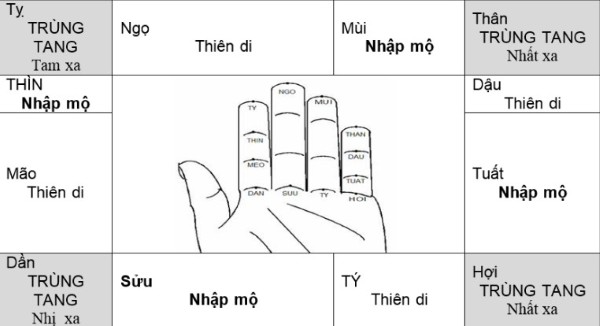
- Bước 3: Kiểm tra xem cung tử của người đã khuất có nằm trong các cung xấu như Tam Tai, Kim Lâu hay Hoang Ốc không.
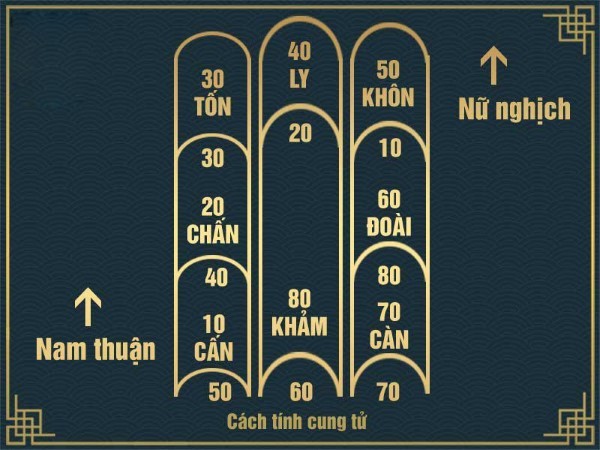
Công thức và ví dụ minh họa cụ thể
Để minh họa cho quy trình tính toán, dưới đây là một ví dụ cụ thể:
Giả sử một người nam tuổi 45 mất vào năm 2023:
- Thông tin đầu vào: Tuổi âm: 45, Giới tính: Nam, Năm mất: 2023
- Kết quả tính toán: Sử dụng bảng cung để xác định cung tử và kiểm tra các yếu tố xấu.
Qua ví dụ này, người thân có thể dễ dàng hiểu và áp dụng vào thực tế để đảm bảo việc tang lễ diễn ra thuận lợi và mang lại sự bình an cho linh hồn người đã khuất.
Ý nghĩa các cung tử trong truyền thống Việt
Các cung tử không chỉ đơn thuần là những thuật toán hay phép tính mà còn chứa đựng những ý nghĩa sâu sắc về tâm linh và phong thủy.
Ý nghĩa các cung tử trong truyền thống Việt
Cung tử tốt/xấu và ảnh hưởng phong thủy
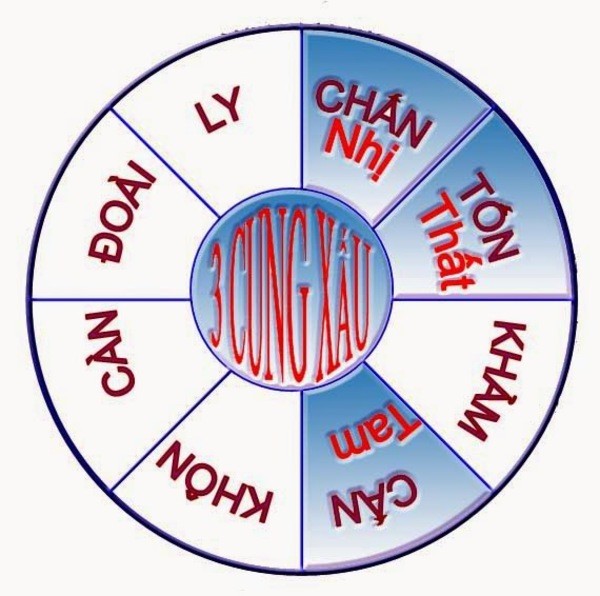
Trong phong thủy, các cung tử được phân loại thành tốt và xấu:
- Cung tốt (Như Cung Khôn, Càn): Mang lại phúc lành, tài lộc cho gia đình. Những cung này thường được ưu tiên trong việc an táng và cúng giỗ.
- Cung xấu (Như Cung Tốn, Chấn): Cần tránh, bởi vì chúng có thể gây ra nhiều vấn đề cho người sống, đặc biệt là trong các mối quan hệ gia đình.
Việc tìm hiểu kỹ về các cung giúp gia đình có thể đưa ra những quyết định đúng đắn hơn trong việc tổ chức tang lễ và cúng giỗ.
Ứng dụng thực tiễn: Khi nào cần tính cung người chết?
Có nhiều tình huống trong cuộc sống mà việc tính cung người chết trở nên cần thiết. Một số trường hợp đặc biệt có thể kể đến như:
- Người mất đột ngột: Những trường hợp này thường khiến gia đình không kịp chuẩn bị, vì vậy việc tính toán ngay lập tức là rất quan trọng.
- Mất trong năm xung tuổi: Điều này có thể mang lại nhiều điều xui xẻo nếu không được xử lý đúng cách.
- Trường hợp khó khăn trong tang lễ: Việc tính cung có thể là cứu cánh cho gia đình trong những lúc khó khăn.
Từ đó, có thể thấy rằng việc tính cung tử không chỉ là một truyền thống văn hóa mà còn là một yếu tố quan trọng trong việc duy trì hòa bình và tài lộc cho gia đình.
Thắc mắc thường gặp khi tính cung người chết
Rất nhiều người thường đặt câu hỏi về cách tính cung người chết, dưới đây là một số thắc mắc phổ biến và giải đáp cho những câu hỏi này.

Những thắc mắc thường gặp về cách tính cung người chết
Người mất trẻ tuổi hoặc mất vào tháng nhuận: làm sao tính chính xác?
Việc tính cung cho những người mất trẻ tuổi hay vào tháng nhuận thường gây khó khăn cho nhiều người. Tuy nhiên, các chuyên gia phong thủy khuyên rằng:
- Sử dụng tuổi âm: Đối với những trường hợp này, hãy sử dụng tuổi âm để tính toán, vì đó là cách chính xác nhất.
- Tham khảo ý kiến chuyên gia: Nếu còn băn khoăn, bạn có thể tìm đến các thầy cúng hoặc chuyên gia phong thủy để được hướng dẫn.
Xử lý trường hợp cung tử xấu rơi vào ngày giờ hiếm
Khi gặp phải trường hợp cung tử xấu, việc xử lý nhanh chóng là rất cần thiết. Một số biện pháp có thể áp dụng gồm:
- Chọn ngày giờ tốt: Cố gắng lựa chọn ngày giờ tốt hơn cho tang lễ, việc này có thể giảm thiểu những ảnh hưởng tiêu cực đến gia đình.
- Thực hiện cúng giải hạn: Tổ chức các lễ cúng giải hạn để cầu xin sự giúp đỡ từ tổ tiên và thần linh.
Những biện pháp này sẽ giúp gia đình tìm được sự bình an và tránh khỏi những điều không may.
Kết luận
Việc tính cung người chết không chỉ đơn thuần là một quy trình mà còn mang trong mình rất nhiều ý nghĩa tâm linh và văn hóa. Qua bài viết này, hy vọng bạn đã nắm bắt được những khía cạnh quan trọng trong cách tính cung người chết, cũng như những lưu ý cần thiết để thực hiện đúng cách. Việc tìm hiểu và tuân thủ những phong tục tập quán này sẽ giúp gia đình duy trì được sự bình an, đồng thời thể hiện lòng thành kính đối với tổ tiên.
